2023年12月19日,我中心林忠辉教授团队在国际生物学领域权威刊物《The EMBO Journal》(最新影响因子11.4)在线发表了题为“Molecular mechanism of allosteric activation of the CRISPR ribonuclease Csm6 by cyclic tetra-adenylate”的研究成果。这是林忠辉教授团队于2023年2月在《Nucleic Acids Research》杂志上发表论文揭示了环状核酸酶Sso2081的分子机制后,在细菌中III型CRISPR天然免疫系统研究领域取得的又一个重要研究成果。

环寡腺苷酸(Cyclic oligoadenylate, cOA)信号通路是细菌III型CRISPR-Cas系统所特有的一种防御外源遗传物质入侵的免疫体系[1,2]。外源核酸的入侵会刺激该系统的特征蛋白Cas10(也称为Csm1或Cmr2)的palm结构域合成cOA分子,这些cOA分子(通常为3-6个3’-5’连接的AMP分子)作为第二信使,能变构激活下游的多种CRISPR辅助核酸酶,从而非特异性地降解外源和宿主DNA或RNA。因此,虽然cOA对于宿主对外来遗传物质入侵的免疫至关重要,但其在细胞内的水平必须受到严格控制,否则可能引起细胞休眠甚至细胞死亡[3]。Csm6是一类特殊的辅助核酸酶,其N端的CARF结构域在结合cOA后,能够别构激活位于C端的HEPN结构域的RNase活性以行使RNA降解功能。此外,CARF结构域还兼具cOA降解活性,即Ring nuclease活性,使HEPN结构域失活以关闭cOA信号通路。值得注意的是,CARF与HEPN两个结构域在空间上相距达70 Å[11,12],关于这种长距离的变构激活机制一直以来是一个令人着迷的科学问题。
该研究以X-射线晶体学为主要研究手段,解析了辅助核酸酶TtCsm6与其底物和切割最终产物等多个催化阶段的晶体结构,并结合HPLC-MS、微量热泳动分析(MST)、荧光共振能量转移(FRET)等生物化学实验技术,揭示了CARF结构域是如何通过结合cOA来变构激活HEPN结构域,而又是如何通过降解cOA来使其失活的分子机制(图1~2)。
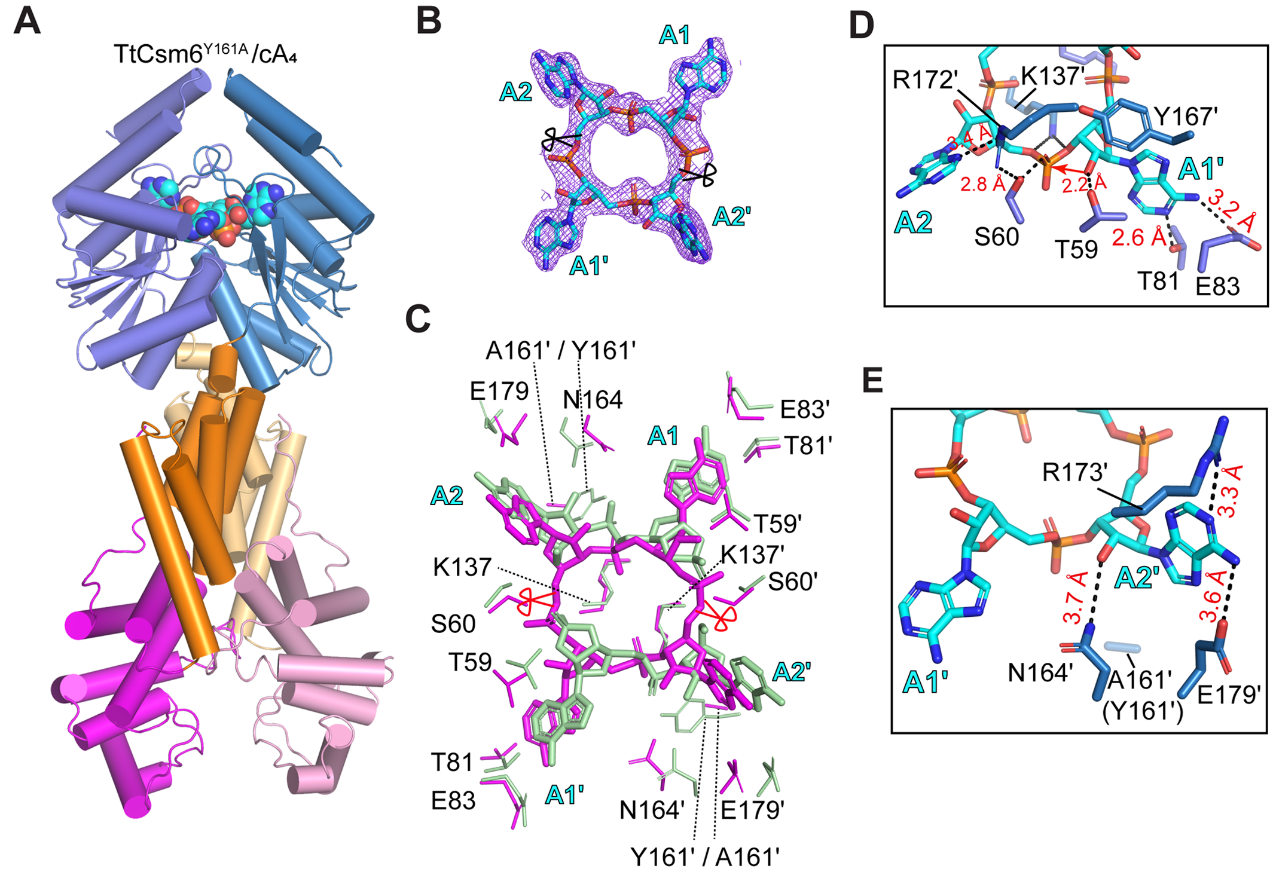
图1. TtCsm6与cA4复合物的晶体结构及二者的相互作用细节图。
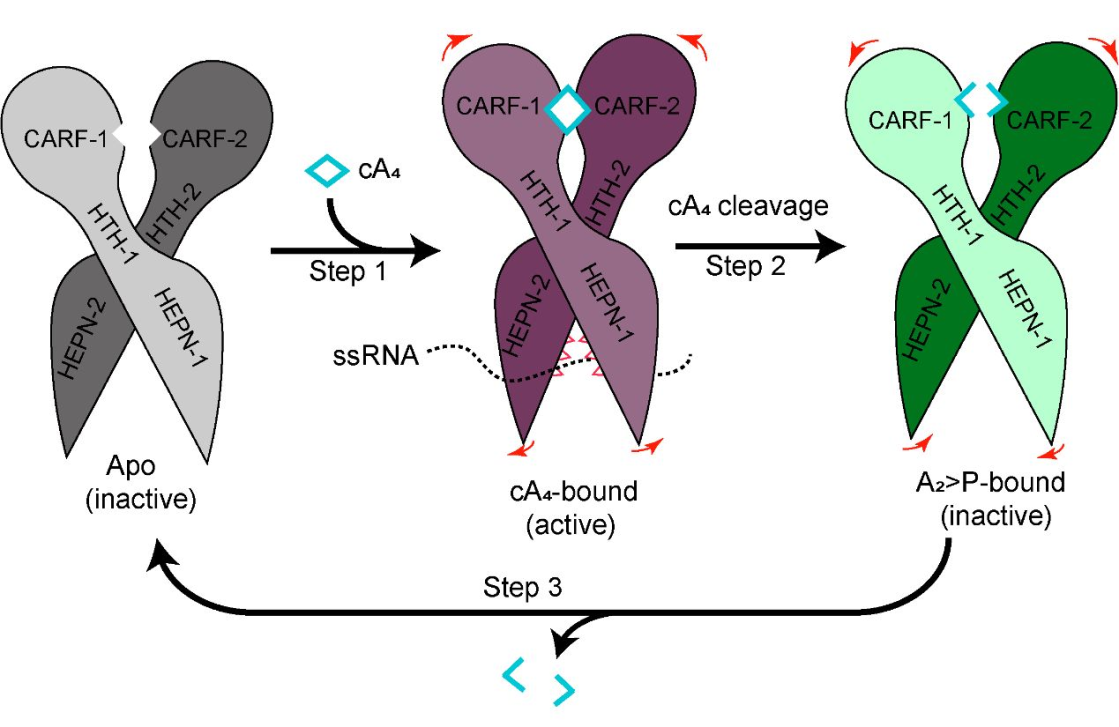
图2. cA4介导的TtCsm6核糖核酸酶变构激活机制的示意图。
此外,该研究还通过点突变技术筛选获得了一个TtCsm6突变体,其CARF结构域能够结合cA4且不对其进行切割,从而可以持续性激活其HEPN结构域的核糖核酸酶活性。该突变体在基因编辑和病毒诊断中将具有重要的应用价值。
我中心林忠辉教授为该论文通讯作者,博士生杜丽阳同学为第一作者。本研究得到了国家高层次青年人才计划、国家自然科学基金、福建省百人计划和福建省高校领军人才专项经费资助。上海同步辐射光源(SSRF)为本研究提供了重要的技术支持。
原文链接:https://www.embopress.org/doi/full/10.1038/s44318-023-00017-w。
参考文献:
[1] KAZLAUSKIENE M, KOSTIUK G, VENCLOVAS Č, et al., A cyclic oligonucleotide signaling pathway in type III CRISPR-Cas systems[J]. Science, 2017, 357(6351): 605-609.
[2] NIEWOEHNER O, GARCIA-DOVAL C, ROSTØL J T, et al., Type III CRISPR-Cas systems produce cyclic oligoadenylate second messengers[J]. Nature, 2017, 548(7669): 543-548.
[3] ROSTØL J T, MARRAFFINI L A. Non-specific degradation of transcripts promotes plasmid clearance during type III-A CRISPR-Cas immunity[J]. Nature Microbiology, 2019, 4(4): 656-662. [12] ATHUKORALAGE J S, GRAHAM S, GRÜSCHOW S, et al., A type III CRISPR ancillary ribonuclease degrades its cyclic oligoadenylate activator[J]. Journal of Molecular Biology, 2019, 431(15): 2894-2899.