生物体包括我们人类每天都会受到的紫外线辐射、自由基和其他化学物质的诱变造成体内遗传物质DNA的损伤,即使没有受到外界环境的影响,细胞自身进行分裂时DNA的复制也会产生错误。而即便如此,为什么绝大部分生物体仍然可以维持其基因组的稳定性而正常生存呢?研究发现,机体内拥有一套保卫系统能够时刻监视并修复着DNA。2015年的诺贝尔化学奖正是颁给了在分子层面上研究这种DNA修复机制的三位科学家。
2019年10月14日,我中心林忠辉教授研究团队在DNA损伤修复分子机制的研究上取得重要进展,论文以“Structural Basis of Sequence-specific Holliday Junction Cleavage by MOC1”为题发表在《Nature Chemical Biology》上。

Holliday junction(HJ)是英国分子生物学家Robin Holliday于1964年首次发现,是在DNA同源重组损伤修复过程中形成的一种十字叉状的DNA连接体,在噬菌体、细菌、真菌、植物乃至动物细胞中均存在。在DNA损伤修复完成后,HJ必须在HJ解离酶的作用下解离,从而促使两条同源DNA双链分开重新成为线性DNA1。MOC1(monokaryotic chloroplast 1)是一个叶绿体特异的HJ解离酶2。
林忠辉教授研究团队结合了结构生物学、计算生物学和大量的生化数据不仅在原子水平上揭示了HJ解离酶——MOC1的催化机制,而且对RuvC家族悬而未决的底物特异性识别机制也提供了重要的启示【图1】。更为重要的是,该研究针对关于核酸酶如何将DNA序列上的微小差异转化成为其催化活性上的巨大不同这一科学问题,创新性地提出了一种双金属离子辅助的DNA序列特异选择性机制。
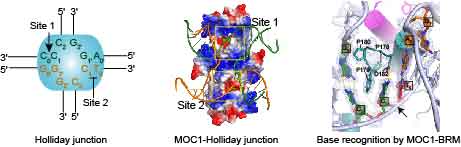
图1. MOC1与HJ的复合物晶体结构
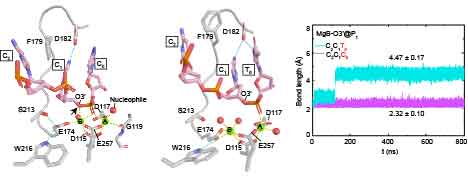
图2.分子动力学模拟揭示DNA底物序列不同引起金属离子配位的变化
我中心林忠辉教授、黄明东教授和李金宇教授为该论文共同通讯作者,博士生林华建、科研助理张丹萍和左柯为共同第一作者,其中林华建由林忠辉教授和黄明东教授共同指导。李金宇教授课题组完成了分子动力学模拟工作。袁彩副教授参与了晶体结构的修正工作。本研究得到了国家级青年人才计划、国家自然科学基金、福建省高层次人才引进计划和福建省高校领军人才专项经费资助。上海同步辐射光源(SSRF)BL17U1/BL18U1/BL19U1为本研究提供了重要的技术支持。
林忠辉于2017年获得国家级青年人才项目支持回到福州大学化学学院担任课题组长,课题组综合化学生物学、X-ray晶体学、生物化学以及分子生物学等研究手段,目前主要从事细胞周期调控和DNA损伤修复的分子机制以及靶向药物研发,以第一作者或通讯作者在Nature3, Nature Chemical Biology4, Cell Chemical Biology5和Structure6等杂志上发表多篇研究论文。目前,课题组正在招聘博士后和科研助理,欢迎对蛋白质结构和药物研发有兴趣的朋友加盟。联系方式:0591-22867831, zhonghui.lin@fzu.edu.cn。
论文全文见附件
参考文献:
1.Lilley, D.M. & White, M.F. The junction-resolving enzymes. Nat Rev Mol Cell Biol 2, 433-443 (2001).
2.Kobayashi, Y. et al. Holliday junction resolvases mediate chloroplast nucleoid segregation. Science 356, 631-634 (2017).
3.Zhonghui Lin, Xuelian Luo, Hongtao Yu*. Structural basis of cohesin cleavage by separase. Nature, 2016, 532: 131-4.
4.Huajian Lin, Danping Zhang, Ke Zuo, Cai Yuan, Jinyu Li*, Mingdong Huang*, Zhonghui Lin*. Two-metal-ion assisted sequence-specific Holliday junction recognition and cleavage by the chloroplast resolvase MOC1. Nat Chem Biol. 2019 (DOI: 10.1038/s41589-019-0377-4).
5.Zhonghui Lin#, Jan K. Jensen#, Zebin Hong, Xiaoli Shi, Lihong Hu, Peter A*. Andreasen*, and Mingdong Huang*. Structural insight into inactivation of plasminogen activator inhibitor-1 by a small-molecule antagonist. Chem Biol. 2013, 20:253-61.
6.Zhonghui Lin#, Luying Jia#, Diana R. Tomchick, Xuelian Luo, Hongtao Yu*. Substrate-specific activation of the mitotic kinase Bub1 through intramolecular autophosphorylation and kinetochore targeting. Structure. 2014, 22:1-12.